Claves para entender la investigación de nuevos fármacos

El coordinador del grupo Bioorgánica de la Universidad de Burgos define la investigación de nuevos medicamentos como un proceso «largo y costoso», y apunta que los altos costes de las pruebas, los amplios plazos y la burocracia son los principales frenos el desarrollo de nuevos fármacos
El investigador del grupo Bioorgánica de la Universidad de Burgos (UBU), Roberto Quesada, fue el encargado de impartir la charla científica ‘Nuevos Fármacos y Enfermedades Raras: del laboratorio al paciente‘ en una nueva edición de Ciencia entre Fogones en la sede de Bebot en Miranda de Ebro.
Con motivo del Día Internacional de las Enfermedades Raras, el doctor en Química empezó su intervención recordando que en España se estima que en hay 3 millones de personas con enfermedades raras y que «de las 7.000 enfermedades raras, solo 400 tienen tratamiento aprobado«. Asimismo, los datos apuntan que los enfermos obtienen un diagnóstico correcto una vez pasado los 4 años.
En este sentido, recordó que su equipo de investigación de la Universidad de Burgos está trabajando en sustituir, con una molécula diseñada en el laboratorio, la función esencial de una proteína que les falla a los afectados por la enfermedad rara de Fibrosis Quística, un reto científico cuyo objetivo es encontrar una cura para la fibrosis quística en todas sus posibles mutaciones.
Investigación de fármacos: un proceso largo y costoso
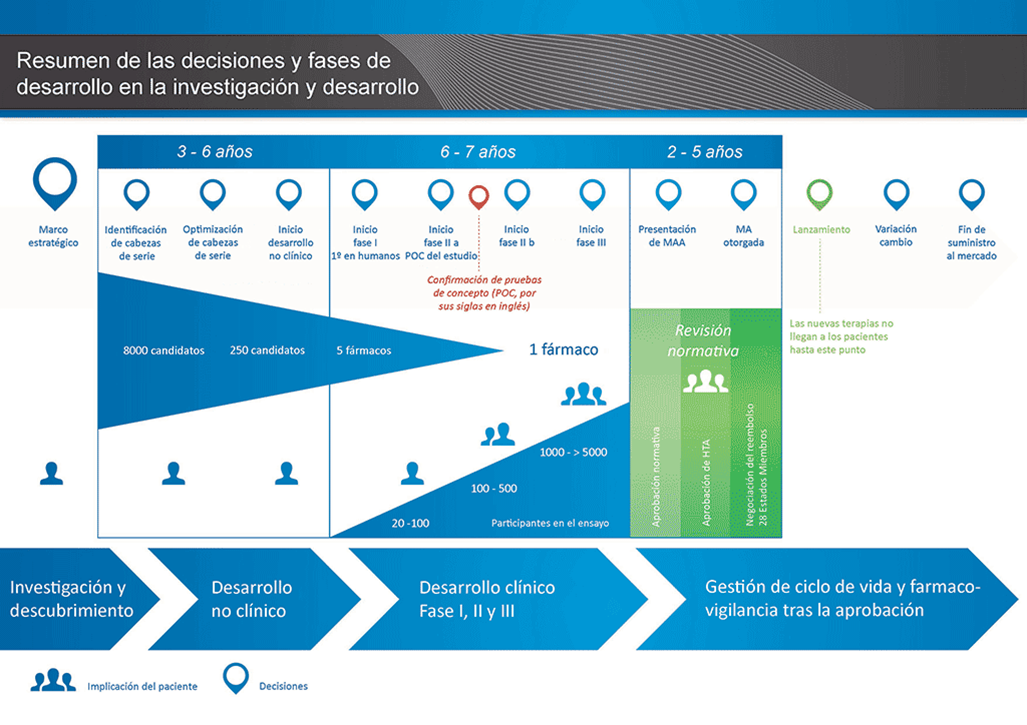
Quesada explicó a los asistentes el porqué muchas veces oímos en los medios de comunicación nuevas investigaciones que prometen acabar con enfermedades importantes como el sida o el cáncer, y luego caen en el olvido. La clave para entender estas noticias es que, generalmente, los periodistas se hacen eco de investigaciones que están en fases previas al desarrollo clínico, y que, por la complejidad del proceso de desarrollo de medicamentos, los equipos tardan años en volver con nuevos resultados o no cumplen las exigencias marcadas por las agencias reguladoras para continuar en su desarrollo. Así, el doctor en Química definió la investigación de medicamentos como «proceso largo» que puede prolongarse entre los 15 a los 30 años .
Academia Europea de Pacientes https://www.eupati.eu/es/ https://creativecommons.org/licenses/by-nc-sa/4.0/
Roberto Quesada expuso las tres fases que, obligatoriamente, conlleva una investigación de medicamentos antes de ser aprobada por los organismos responsables:
- Descubrimiento de una ‘diana terapéutica’. Detrás de un fármaco hay un principio activo que corresponden a ‘moléculas pequeñas’, es decir, tienen una escala diferente a los polímeros o las proteínas -que son moléculas muy grandes. Para identificar esas ‘moléculas pequeñas’ que van a formar parte de un medicamento, se busca antes una ‘diana terapéutica’ a la que poder dirigirla y que haga que mejoren los síntomas de una enfermedad. Las dianas terapéuticas son estructuras funcionales que todos tenemos, y que dejan de funcionar cuando se produce una enfermedad. Pueden ser: enzimas, canales iónicos, proteínas, lípidos o ácidos nucleicos. Por tanto, el primer paso es determinar un lugar del organismo donde un fármaco puede actuar para curar la enfermedad, y después se sintetiza esa molécula en el laboratorio para garantizar su suministro en el caso de que la investigación progrese.
- Los estudios pre-clínicos. En esta fase se ensaya exhaustivamente el compuesto seleccionado en el laboratorio para confirmar que su administración en humanos será segura. Son estudios de estabilidad y toxicidad de los compuestos, en los que se hacen pruebas en células o tejidos –in vitro– y en animales como ratones –in vivo-. El objetivo es el desarrollo de compuestos efectivos y seguros. Esta etapa de la investigación prevé la propia formulación del medicamento (para que haga efecto en un lugar específico del cuerpo, por ejemplo) y estudios sobre farmacología y toxicología. Una vez que el equipo de investigación completa los estudios preclínicos y encuentra la molécula efectiva y segura, se solicita una solicitud a las agencias reguladoras para pasar a la siguiente etapa: la fase clínica.
- Desarrollo clínico. A diferencia de las fases anteriores, en la fase clínica se testa con humanos. Son «poquísimos» los compuestos de nuevos fármacos que llegan a la fase clínica de investigación, ya que han de ser muy prometedores antes de lanzarse a invertir grandes sumas en su investigación. A su vez, el desarrollo clínico en la investigación de nuevos fármacos se subdivide en:
- Fase 1: Se busca testar la seguridad del medicamento (efectos secundarios, metabolismo) en una pequeña muestra de personas voluntarias. Número de personas requeridas: 180 personas.
- Fase 2: Estudio con un número reducido de pacientes (20-80 pacientes) en el que se busca la efectividad del compuesto. La gran mayoría de medicamentos fallan en esta fase.
- Fase 3: En este punto, los estudios y pruebas se practican, normalmente, a nivel internacional e involucran a muchos más pacientes (entre 1000-3000 enfermos). Se busca confirmar tanto la efectividad como la seguridad en una muestra más grande, y se prueba con diferentes dosis para determinar cuál es la medida correcta. Tiene un índice de éxito muy bajo, entre un 25 o 30% superan las pruebas.
- Aprobación y comercialización del medicamento por parte de las agencias reguladoras (Agencia Europea del Medicamento para el territorio europeo).
Hay un dato que evidencia la complejidad del proceso: “Solo 1 de cada 10.000 compuestos que entran en la fase del desarrollo clínico y empiezan a testarse llegan a aprobarse , según datos de la FDA (Administración de Alimentos y Medicamentos de los Estados Unidos)».
Por otra parte, el coste de investigar medicamentos es muy costoso debido a que la mayoría de fármacos en fases de investigación no llegan a aprobarse. «De hecho, cada año sólo se aprueban entre 20 a 40 medicamentos anuales para todas las enfermedades», destacó el científico.
Las farmacéuticas suelen justificar sus altos precios argumentando que el desarrollo de un fármaco cuesta unos 2.600 millones de dólares.
Y su modelo de negocio se basa en repercutir la inversión que supone las fases clínicas de compuestos fallidos en la comercialización de aquellos fármacos que sí logran ser aprobados.

Ciencia entre Fogones se desarrolla en un ambiente distendido donde los asistentes tienen una relación de proximidad con el ponente
Proceso de investigación en enfermedades raras
La conexión entre las enfermedades raras y la investigación de fármacos es más compleja que si se diera en enfermedades más normalizadas, subrayó en investigador. Quesada puso un ejemplo de las dificultades en la propia investigación de fármacos dirigida a tratar las enfermedades raras. «En una fase pre-clínica testada con animales es muy difícil desarrollar una enfermedad rara que tenga los mismos síntomas en ratones. Los ratones que tienen fibrosis quística no tienen los mimos síntomas a nivel pulmonar que los humanos, sin embargo es más fácil trasladar un tipo de cáncer específico en ratones y así estudiar la eficacia que tiene un determinado medicamento». Otra de las diferencias, es que en las fases clínicas es complicado conseguir muestras grandes de pacientes para testar los medicamentos, no pudiéndose completar las estadísticas que exige la ley.
Reducción de costes en la investigación de medicamentos
Sin embargo, la principal dificultad con la que tiene que lidiar la investigación de nuevos fármacos es de índole económica. Las empresas privadas -farmacéuticas- se mueven por la rentabilidad del producto, y no invierten grandes sumas de dinero en descubrir una enfermedad con pocos pacientes -o en enfermedades comunes extendidas entre pacientes pobres como pudiera ser el caso de África.
El desarrollo farmacológico para enfermedades graves con un bajo número de afectados tienen un estatus especial: enfermedad huérfana.
Bajo esta denominación las administraciones intentan incentivar económicamente la investigación de nuevos fármacos con medidas como la reducción de tasas y el otorgamiento de licencias de 10 años en exclusividad de mercado.
Para reducir los costes en la investigación de nuevos fármacos también se utiliza el reposicionamiento de medicamentos, es decir, comprobar si un fármaco que ya está aprobado o está en fases clínicas tiene efectividad para otras enfermedades. Por ejemplo: La metformina utilizada para el tratamiento de la diabetes tipo 2 se ha demostrado que es efectiva para un tipo de epilepsia, expuso el químico.
Otro de los ejemplos que mencionó el experto es el caso de la investigadora belga Els Torreele, cuyo grupo de investigación desarrolló recientemente un fármaco contra una enfermedad olvidada, al margen de la industria farmacéutica. En este caso, el coste se vio reducido de 2600 millones de euros a 55 millones, explica la noticia publicada en el diario El País. La biotecnóloga recuperó viejas moléculas que ya habían sido investigadas y desarrolló una nueva fase clínica en África, abaratando así su coste. Finalmente contó con la ayuda de una farmacéutica francesa, firma que donó la fabricación del compuesto valorado en unos 13 millones de euros.
La belga @ElsTorreele crea un fármaco contra la enfermedad del sueño al margen de la industria farmacéutica, y reduce su coste a 55 millones de euros frente a los 2.600 millones de dólares. 🎙️¡De todo esto hablaremos hoy jueves en #cienciaentreFogones! https://t.co/VGNsZuR1Ol
— Bebot (@BebotCommunity) February 28, 2019
